L’imaging mediante la microscopia ottica, in fluorescenza, confocale ed elettronica permette di effettuare studi in vitro, in vivo e/o ex vivo spaziando dalla caratterizzazione di strutture subcellulari a microorganismi e rendendo possibile acquisire dati relativamente ad un piano di fuoco molto ristretto. L’Imaging in vivo riduce il numero di animali necessari alla sperimentazione sia perché permette una longitudinalità degli studi, ovvero l’utilizzo di uno stesso animale a tempi diversi (Reduction) sia perché diminuisce le variabili sperimentali; inoltre, riduce il livello delle sofferenze inflitte (Refinement) potendo esaminare l’animale sotto anestesia senza bisogno di sacrificarlo.
- Confocale invertito Leica TCS SP5 AOBS. Microscopio confocale completo di microscopio rovesciato, obiettivi (5-10-20x ad aria, 40 e 63x ad olio, 63x al glicerolo, e sono disponibili anche 100x ad olio e obiettivi a contrasto di fase). 4 Laser: lunghezze d’onda disponibili: 405nm, 458nm, 476nm, 488nm, 496nm, 514nm, 543nm, 633nm. Il segnale puo’ essere rivelato su 5 detector di cui 2 Hybrid e 3 PMT classici e inoltre è presente 1PMT esterno per l’immagine in bright field. E’ presente un tavolino motorizzato che permette di fare mosaico e time lapse su piu’ punti del campione in contemporanea e un incubatore con termostatazione e CO2 che permette di fare live cell imaging. L’attrezzatura permette di studiare cellule e tessuti fluorescenti ex vivo e di effettuare esperimenti di live cell imaging. Il software è inoltre equipaggiato di wizard per FRET-AB, FRET-SE, FRAP, live data mode Lo strumento è equipaggiato di Resonant scanner a 8000 Hz. Questa macchina è stata dotata recentemente di videocamera a fluorescenza (Hamamatzu), software di acquisizione e analisi Metamorph e sistema Gemini per fare FRET in widefield.
- Confocale-Multifotone Leica TCS SP5 AOBS. Microscopio diritto, obiettivi a lunga distanza focale (HCX APO L 10x/0.30 W, HCX APO L 20x/0.50 W U-V-I -/D 3.5, HCX APO L 40x/0.80 W UVI, HCX APO L 63x/0.90), videocamera a fluorescenza e 4 laser visibili (lunghezze d’onda disponibili: 405nm, 458nm, 476nm, 488nm, 496nm, 514nm, 543nm, 633nm). Il laser multifotone è un Chameleon Ultra (Coherent) tunable da 690 a 1080nm il cui core e’ un cristallo di Titanio-Zaffiro. La microscopia multifotone è una tecnica di microscopia ottica in fluorescenza in cui il campione è eccitato, in corrispondenza del punto focale, da luce laser pulsata infrarossa. Le lunghezze d’onda lunghe permettono: i) una profondità di penetrazione della radiazione incidente più elevata rispetto alla radiazione visibile e ìì) di generare pochissimo decadimento della fluorescenza (photobleaching). Un uso tipico della microscopia multifotone consiste nell’osservazione di cellule eucariotiche in preparati spessi come organoidi, linfonodi, fettine di tessuto o nell’animale in vivo: ad es. neuroni o microglia nella corteccia cerebrale di topi transgenici esprimenti proteine fluorescenti. Recentemente questa macchina è stata dotata di un set completo di laser e di obiettivi ad aria e olio per renderla utilizzabile anche come confocale.
- Confocale rovesciato EVIDENT FV4000. Microscopio confocale completo di microscopio rovesciato, obiettivi (4-10-20x ad aria, 20X LONG DISTANCE, 30x Silicone e 60x olio). 8 Laser a diodo (405, 445, 488, 514, 561, 594, 640, 785). Il segnale puo’ essere rivelato su 6 detector SiPM 16 bit e detection fino al 900nm. Disponibile un PMT per il Bright Field. E’ presente un tavolino motorizzato che permette di fare mosaico e time lapse su piu’ punti del campione in contemporanea e un incubatore con termostatazione e CO2 che permette di fare live cell imaging. L’attrezzatura permette di studiare cellule e tessuti fluorescenti ex vivo e di effettuare esperimenti di live cell imaging. Lo strumento è equipaggiato di Resonant scanner 1024×1024 e dispositivo di controllo del fuoco. Deconvoluzione integrata e software Cell Sens di analisi.
- Workstation di analisi con i seguenti software: IMARIS 10.2 (Andor), CellSens (Evident), Huygens (SVI).
- Optical Imager IVIS Lumina S5 Revvity. La tecnica Imager Ottico è dedicata al rilevamento di fotoni ottici, in particolare nella regione del rosso e del vicino infrarosso (NIR). I processi più importanti sono l’emissione di fluorescenza (eccitazione di fluorofori iniettati negli organismi) e l’emissione di bioluminescenza (reazioni enzimatiche che producono luce). La tecnica OI è molto sensibile (a livello delle singole cellule), ripetibile, sicura, molto veloce ed economica. IVIS è costituito da un Charge Coupled Device (CCD) raffreddato a -90 ° C con efficienza quantica superiore all’85% tra 500 e 700 nm e superiore al 30% tra 400 e 800 nm dotato di filtri di eccitazione e di emissione e di configurazione trans-illuminazione per consentire una acquisizione in fluorescenza. Il sistema è dotato di ampio range di filtri di eccitazione e di emissione; funzione di “spectral unmixing” per garantire una separazione accurata dei segnali fluorescenti/bioluminescenti provenienti da diversi componenti per quantificazione individuale. Il sistema è anche dotato di una licenza per l’imaging multimodale, al fine di combinare le immagini provenienti da diverse modalità di imaging (TAC, PET, risonanza magnetica e OI). Nella modalità di fluorescenza, lo strumento sfrutta emissione di fluorescenza di coloranti iniettati negli organismi viventi. Inoltre, diversi tipi di cellule (comprese le cellule staminali) possono essere marcate con molecole fluorescenti permettendo di studiare il loro homing in vivo. Nella modalità bioluminescenza, OI rileva la luce emessa nelle reazioni enzimatiche. Recentemente, proprio qui a Verona è stata scoperta e sviluppata la Cerenkov Luminescence Imaging (CLI), una nuova tecnica, mettendo insieme Optical Imaging e Medicina Nucleare. CLI è stato già utilizzato negli esseri umani.
-
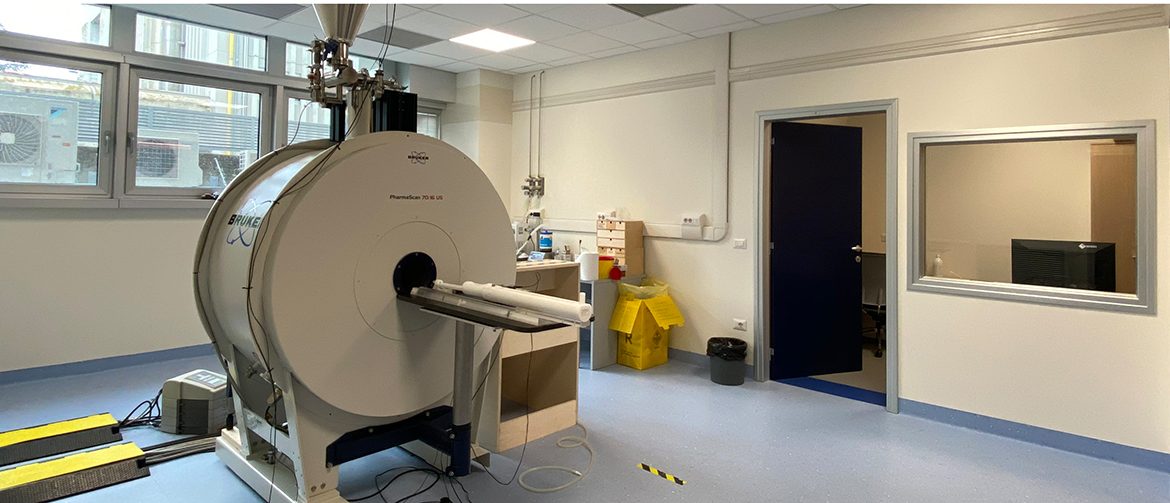
Tomografo a Risonanza Magnetica (Bruker Biospin) per piccoli animali. Il sistema MRI è dotato di un magnete orizzontale superconduttore Ultra Shielded operante ad un campo di 7 Tesla e con un bore da 16 cm (Pharmascan 70/16 US Bruker). Il sistema si basa su elettronica Bruker Avance II e un inserto di gradienti Bruker B-GA9S HP con intensità massima di 380 mT/m. E’ equipaggiato di cinque bobine di acquisizione: volumetrica per topo e ratto, superficiale ad elmetto per topo e ratto e superficiale a 4 canali per topo. Per le acquisizioni in vivo, il sistema è dotato di apparecchiatura per anestesia gassosa, misurazione dei parametri vitali e riscaldamento per animali. Le immagini RM standard sono molto sensibili e in grado di distinguere tra tumori e edema perifocale. Similmente, nel Sistema Nervoso Centrale (CNS), la RM standard permette di valutare le lesioni, la permeabilità della barriera ematoencefalica, l’atrofia. Nelle applicazioni avanzate permette di misurare il flusso ematico (usando Arterial Spin labeling), la risposta funzionale ad uno stimolo (utilizzando BOLD), la connettività assonale (Diffusion Tensor Imaging) e la connettività funzionale. A campo alto infine, la Spettroscopia di Risonanza Magnetica localizzata (MRS) consente il rilevamento non invasivo e la quantificazione dei diversi metaboliti cruciali per la stadiazione dei tumori e per definire le patologie del CNS, come ad esempio N-acetil aspartato (NAA), colina (Cho), creatina (Cr), myo inositolo (MI), e composti del glutammato e glutammina (Glu-n).
Per prenotazioni e informazioni si veda la pagina Come funziona.